De l’intérêt d’une réforme
L’exemple du MEDIATOR®
Par Jean-Pierre Bader - Mars 2011
Texte présenté au colloque organisé par le cabinet UGGC & Associés,
le 23 mars, sur le thème " Réforme de la pharmacovigilance";
I - De la quasi-liberté de l’indication thérapeutique
Dans le sillage d’importants travaux du laboratoire SERVIER dans les années 1960 sur les dérivées amphétaminiques, ce laboratoire commercialise en 1963 la Fenfluramine ou PONDERAL® qu’il présente sans ambiguïté comme « un anorexigène puissant ayant perdu la toxicité de type amphétaminique ».
C’est ensuite dans les années 1970 qu’apparaît le benfluorex ou MEDIATOR®, apparemment de la même famille, mais que le laboratoire présente d’emblée comme « un produit profondément original, doté de propriétés métaboliques spécifiques et dénué d’action anorexique ».
La mise sur le marché du MEDIATOR® s’inscrit dans un environnement réglementaire embryonnaire, la législation communautaire n’ayant pas encore exercé tous ses effets... cliquer pour continuer
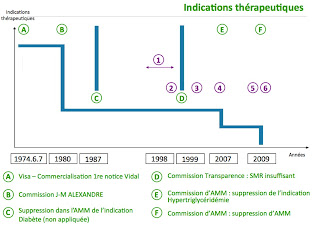
En juin 1974, le « Comité du visa » du Service central de la pharmacie et du médicament, au sein du ministère de la Santé, comité qui réunit quelques fonctionnaires du ministère, accorde au MEDIATOR® l’autorisation de mise sur le marché avec les indications thérapeutiques suivantes :
— troubles métaboliques glucido-lipidiques athérogènes ;
— troubles du métabolisme lipidique ;
— troubles du métabolisme glucidique.
Les effets secondaires signalés comme possibles étant : quelques troubles digestifs, de l’asthénie, de la somnolences et des vertiges.
Il faut avoir à l’esprit que non seulement la réglementation était embryonnaire mais aussi que les moyens humains et matériels ne peuvent pas être comparés avec ceux dont bénéficient aujourd’hui l’Afssaps et la Haute autorité de santé. La question de l’indépendance des experts ne se posait absolument pas.
La commercialisation du produit commence en 1976.
Et en 1977, apparaît pour la première fois dans les publications médicales, la notice suivante, qui, il faut le rappeler, n’était soumise à aucun contrôle par l’Administration. L’éditeur n’avait aucune compétence pour émettre la moindre critique sur ces informations. À cette époque, l’information médicale était élaborée par le titulaire de l’autorisation de mise sur le marché et transmise directement à l’éditeur de la publication ou du Dictionnaire médical.
Le contenu de la notice publiée ne peut que laisser perplexe :
En effet, le RCP montre trois indications :
— Les hyperlipidémies (en évoquant « une épuration plasmatique pour les triglycérides ») ;
— Le diabète où, en association avec les traitements classiques, il est « un traitement d’appoint important » ;
— L’athérosclérose, en luttant contre tous les métaboliques des lipides et des glucides, l’hyperuricémie, l’hypertension artérielle, l’anxiété et la vasoconstriction.
II –De la genèse de l’administration du médicament
Un changement politique va modifier cette organisation industrielle et réglementaire qui va perturber la commercialisation de ce médicament.
Mme Simone Veil est nommée ministre de la santé le 28 mai 1974. J'étais membre de son cabinet. La Ministre donne son accord pour la mise en place d’une sérieuse et efficace administration du médicament. Elle désigne Jean Weber comme Directeur de la pharmacie et du médicament.
Ainsi fut créée en 1976, la Commission de contrôle du dictionnaire des médicaments, sous la direction de Jean Michel Alexandre. Assistée d’une équipe de pharmacologues, cette commission élabore de véritables fiches contrôlées d’indications thérapeutiques.
En 1978, fut créée la nouvelle commission d’autorisation de mise sur le marché sous la présidence de Marcel Legrain, néphrologue, conseiller auprès de Simone Veil, ministre de la Santé de 1974 à 1979. Il présida cette commission de 1978 à 1985.
En 1979, fut créée la commission de pharmacovigilance que j'ai eu l'honneur de présider.
En 1980, fut créée la Commission de transparence.
Ces différentes commissions, dont la principale mission fut de modéliser le paysage pharmaceutique français, ne furent pas accueillies dans la sérénité par les industriels du médicament. Méfiance et réticences, tels étaient les premiers sentiments de la profession qui redoutait la multiplication des contraintes administratives et l’allongement des délais d’autorisation liées au fonctionnement de ces structures administratives.
Ces inquiétudes furent de courte durée. En effet, si l’on en croit la réflexion de Gilles Bardelay, fondateur de la revue « Prescrire » qui publia, en janvier 1992, un éditorial en ces termes sous le titre « Pendant 7 ans » :
« Pendant 7 ans, de 1975 à 1981, le bon usage du médicament a connu son heure de gloire en France ;
Les responsables politiques de l’époque se préoccupaient vraiment de moderniser les structures étatiques […] ; créant la DPHM et mettant en place le système d’expertise ».
Les travaux de ces commissions ne furent pas sans incidences sur les indications thérapeutiques qui étaient précédemment enregistrées sans passer sous les fourches caudines de l’Administration.
En 1980, les travaux de la commission dite « ALEXANDRE » et de la commission, d’autorisation de mise sur le marché (AMM) se traduisirent dans les publications spécialisées telles que le VIDAL par une refonte des indications dont celles du MEDIATOR®. » Ce fut un véritable « coup de rabot » sur ces indications ».
Ainsi, les indications thérapeutiques seront modifiées comme suit :
1- L’indication « Hyperlipidémies » se réduisit à : « proposé dans les hypertriglyceridémies ».
2- L’indication « Diabète » se réduisit à : « adjuvant du régime dans le diabète asymptomatique ».
3- Quant à l’indication « Artériosclérose », la plus glorieuse, elle disparaîtra complètement.
En 1987, la commission d’autorisation de mise sur le marché confirme l’indication « Hypertriglyceridémie » avec la mention « adjuvant au régime » et elle supprime l’indication « adjuvant au régime diabétique ».
Mais, cette modification des indications ne fut pas mise en œuvre. Sauf dysfonctionnement majeur du fonctionnement des services de l’État, il est difficile de mettre en avant une explication rationnelle à une décision qui fut inappliquée pendant 20 ans.
Il a fallu attendre l’année 1999 pour que la Commission de transparence après examen du dossier, conclue à un Service Médical Rendu (SMR) insuffisant.
En 2007 la Commission d’AMM intervient sur l’indication « diabète » au vu d’une nouvelle étude et supprime l’indication « Hypertriglycéridémie ».
La Direction de l’Évaluation du Médicament de l’Agence a informé le laboratoire concerné en ces termes :
« Les résultats de votre étude (Moulin) semblent montrer une efficacité sur l’HbAic […] Néanmoins, à ce jour, aucune conclusion définitive ne peut être portée sur cette efficacité ! Toutefois, dans l’attente des réponses complémentaires et des résultats de l’inspection […] aucun motif de protection de la Santé publique ne s’oppose à ce que l’indication soit maintenue ».
Figure 1. Médiator® - Évolution dans le temps des indications et des autorisations.
Figure 2. Médiator® - Les alertes sanitaires successives.
III – De la gestion des risques
Ce dossier a mis en évidence une gestion des risques que nous pouvons considérer comme anormale entre 1981 et 2007.
La Société n’a pas tiré tous les enseignements de l’histoire de l’Isoméride, médicament coupe-faim, alors que le MEDIATOR® est de la même famille.
Après la délivrance de l’autorisation de mise sur le marché en 1985, la pharmacovigilance avait mis en évidence quelques cas d’hypertension artérielle pulmonaire qui justifiaient, dans la mise à jour de l’autorisation de mise sur le marché, en 1992, un appel à surveillance et, en 1995, une mise en garde.
Mais c’est aux États-Unis, pays dans lequel la licence avait été vendue que la crise éclata, débouchant sur une « class action » et aboutissant au retrait du produit en même temps que celui du Pondéral® en France en 1997.
C’est aussi en 1995 que le directeur général de la santé signe un arrêté qui « pour éviter la survenue d’une maladie pulmonaire grave et souvent mortelle » interdit la prescription magistrale en pharmacie des anorexigènes, en incluant dans sa liste le benfluorex, principe actif du MEDIATOR® qui continue d’être prescrit par les médecins en tant que spécialité. La raison de son exclusion de l’arrêté ministériel reste inexplicable.
Commencent aussi à apparaître des cas isolés ou regroupés d’HTPA ou de valvulopathies, à propos desquels se posent toujours les mêmes questions : la maladie est elle authentifiée ? Son origine iatrogène est-elle plausible ? Le médicament est-il directement en cause ? Que valent les grandes études épidémiologiques sur dossiers de la Sécurité sociale ?
Nous assistons aujourd’hui à une guerre des chiffres, sur le nombre de personnes qui seraient victimes de ce médicament, de quelques dizaines à plusieurs centaines. Cependant quelques données frontières existent, ne serait-ce que le nombre approximatif de valvulopathies hospitalisées en France par année, environ 600, dont seulement une petite fraction peut correspondre histologiquement et étiologiquement à une origine médicamenteuse type MEDIATOR®.
De toute façon, ce débat n’a pas de sens. Tout médicament qui serait à l’origine de quelques décès doit être d’urgence retiré du marché, d’autant plus que le gain thérapeutique est soit réduit, soit inexistant.
Puis nous voici en 2007, avec une Agence qui accorde une autorisation de mise sur le marché (AMM) pour la « mini » indication d’« adjuvant au régime du diabète », en précisant qu’il n’y a pas de conclusion définitive sur l’efficacité du produit et où, sur le plan de la tolérance, sont négligées toutes les alertes signalées, pour sortir du chapeau une statistique d’un cas d’HTPA imputée au produit pour 17 204 533 mois de traitement, chiffre impressionnant, alors que la commission de pharmacovigilance qui l’avait précédé de peu demandait le retrait du produit.
Le débat s’est poursuivi avec des propositions de nouvelles études, dont l’étude Régulate qui suscite des interprétations diverses.
La Commission nationale de pharmacovigilance du 29 septembre 2009 a estimé que ses résultats confortaient la notion de valvulopathie associée au MEDIATOR®. Par un vote de 25 voix et une abstention, la Commission déclare que le profil de tolérance du produit est inacceptable. La Commission d’autorisation de mise sur le marché, du 12 novembre 2009, a voté pour la suspension de l’AMM par 18 voix sur 22. Le benfluorex a été définitivement retiré par décision du Directeur général le 20 juillet 2010, soit 34 ans après sa mise sur le marché.
Quelle conclusion de cette approche quelque peu insuffisante des risques ?
Porter un jugement sur 35 années d’histoire et en tirer des conséquences pour l’avenir peut sembler une gageure mais il faut la tenter en segmentant.
1 - Un avant 1976 avec un quasi vide réglementaire.
2 - La création d’un système d’expertise dans le Ministère de Madame Simone Veil avec Jean Weber comme nouveau directeur de la Direction de la Pharmacie et du Médicament entre 1976 et 1981.
3 - La poursuite du travail par cette direction jusqu’à la création, en 1993, de l’Agence du Médicament devenue ensuite l’ Afssaps.
Un observateur extérieur de l’Administration a émis un avis quelque peu mitigé sur cette période, le Directeur de Prescrire, Gilles Bardelay en 1992:
« La période de 1975 à 1981, période de création et de démarrage fut très productive mais dans les 10 ans suivants, de 1981 à 199,1 elle fut considérablement dégradée » D’où le grand espoir mis dans la création de ces Agences.
Force est d’admettre que le MEDIATOR®, entre 1981 et 2009, s’est maintenu dans une démonstration de plus en plus fragile de ses indications thérapeutiques officielles, alors que se développait la confirmation de la qualification du produit comme anorexigène, propriété farouchement niée par le laboratoire, mais hélas bien réelle, pouvant justifier les risques cardiovasculaires.
Parallèlement, cette toxicité, signalée dans les années 1990, ne fut prise en considération par les experts de l’Agence qu’avec une grande lenteur. L’analyse des carences du système et les propositions de réformes vont occuper pendant de longs mois les experts, les politiciens et les citoyens patients potentiels.
Conflits d'intérêt : brefs commentaires
Je ferai ces quelques commentaires simples tirés de mon expérience personnelle.
Le premier porte sur les « célébrissimes » mais réels conflits d’intérêt. On laisse entendre que la quasi-totalité des experts chargés par les autorités ministérielles d’étudier les qualités et défauts des médicaments dont on va autoriser l’usage… sont « payés par les laboratoires pour rendre leurs avis » !
Le fait ne peut pas être nié. Les experts entretiennent des relations scientifiques, médicales, pharmaceutiques à travers des expertises qui sont rémunérées. Mais quelles sont les alternatives ?
L’expertise est d’autant plus efficace qu’elle résulte à la fois d’une expérience médicale « sur le terrain », auprès des malades, et d’une expérience de recherches en liaison étroite avec les laboratoires. Cette double expérience renforce la qualité de l’évaluation réalisée sur les produits présentés par les firmes. Les activités sont complémentaires, et un expert officiel qui n’aurait pas travaillé sur le terrain avec les laboratoires aurait pour l’expertise de vraies lacunes de jugement.
Ensuite, des règles déontologiques connues de tous les experts existent et doivent être respectées. Ces règles sont telles qu’un expert de commission ne peut pas intervenir sur l’appréciation d’un produit au développement duquel il aura participé. La transparence des situations et des rémunérations est également importante. Il appartient à l’Administration de faire respecter ces pratiques.
Second commentaire : Dans la mesure où ces conflits d’intérêt reposent essentiellement sur des liens financiers, il faut admettre que seules des sanctions financières seraient le plus à même d’inciter un laboratoire à ne pas prendre de risques sur la dangerosité d’un produit. Peut-être pouvons-nous nous étonner du prix relatif donné à la vie entre les tribunaux nord-américains et français.
La gestion de la santé repose sur des règles du jeu reconnues par tous les acteurs, sur des structures efficientes qui dialoguent et qui sont ouvertes au monde, et sur des experts peut-être peu nombreux mais reconnus en tant que tels dans leur domaine.

Aucun commentaire:
Enregistrer un commentaire